深度:电子是怎么绕原子核运动的?根本不是太阳系模型!超级复杂
电子到底是怎么绕原子核运动的?
你知道电子是怎么绕着原子核运动的吗?
如果你还停留在高中化学的印象,你可能会想象电子就像地球一样围绕着太阳一样的原子核转圈圈。但是,这种想法其实是错误的,因为电子的运动规律跟一般物体不同,它没有明确的轨道。
那么,电子到底是怎么运动的呢?
下面让我们一起来探索一下电子云模型,这是一个更接近真实情况的模型,不同于我们的直觉,它用概率来描述电子在原子核外空间的分布。
首先,我们要了解一下量子力学,这是一个研究微观粒子行为的理论。量子力学告诉我们,我们不能同时准确地测定出电子在某一时刻所处的位置和运动速度,也不能描画出它的运动轨迹。这就是著名的不确定性原理。因此,我们只能用一个数学函数来描述电子的状态,这个函数叫做波函数。波函数可以告诉我们电子在某个空间范围内出现的概率,而不是电子在空间中的运动轨迹。

那么,如何得到波函数呢?
这就需要解一个方程,叫做薛定谔方程。这个方程是量子力学中最重要的方程之一,它可以用来描述任何微观粒子的状态。但是,这个方程很复杂,只有在一些特殊情况下才能解出来。其中一个特殊情况就是氢原子,也就是只有一个质子和一个电子的最简单的原子。
当我们解出氢原子的薛定谔方程时,我们会发现波函数有四个参数,分别叫做主量子数n、角量子数l、磁量子数m和自旋量子数ms。这四个参数可以用来区分不同的波函数,也就是不同的电子状态。每一个波函数都对应一个能量值,也就是电子在这个状态下所具有的能量。能量越低,表示状态越稳定。

主量子数n表示电子离原子核有多远,n越大,表示电子越远。n可以取任意正整数,比如1、2、3等等。主量子数n决定了电子所处的能层,在高中化学中我们用K、L、M、N等字母来表示不同的能层。
角量子数l表示电子绕原子核转圈圈的形状有多复杂,l越大,表示形状越复杂。l可以取从0到n-1之间的整数,比如0、1、2等等。角量子数l决定了电子所处的能级,在高中化学中我们用s、p、d、f等字母来表示不同的能级。
磁量子数m表示电子绕原子核转圈圈的方向有多歪斜,m越大或越小,表示方向越偏离水平面。m可以取从-l到l之间的整数,比如-1、0、1等等。磁量子数m决定了电子所处的轨道,在高中化学中我们用数字来表示不同的轨道。
自旋量子数ms表示电子自己旋转的方向有多不同,ms只有两种,要么是上,要么是下。自旋量子数ms决定了电子的自旋,我们用↑或↓来表示不同的自旋。
这样,我们就可以用四个参数来描述一个电子的状态,比如1s↑,表示电子在第一能层的s能级上,方向为0,自旋为上。这四个参数也叫做四种量子数,它们可以用来区分不同的电子。
但是,并不是所有的电子都可以随便选择这四个参数,它们还要遵守一些规则。其中最重要的规则就是泡利不相容原理,它说:在一个原子中,不能有两个电子具有完全相同的四种量子数。也就是说,每个电子都要有自己独一无二的状态,不能和别的电子重复。
这个原理听起来很奇怪,为什么电子不能有相同的状态呢?
其实,这是因为电子的本质是波函数,而波函数具有反对称性。反对称性就是说,如果两个电子具有完全相同的四种量子数,那么它们的波函数就会相互抵消,导致电子消失。这显然是不可能的,所以电子必须避免这种情况发生。

泡利不相容原理对我们理解原子结构和化学性质有很大的帮助。它可以解释为什么原子中只能有一定数量的电子,为什么原子外层最多只能有8个电子,为什么原子之间会形成化学键等等。如果没有泡利不相容原理,那么所有的核外电子都会占据到能量最低的基态原子轨道上。所有的电子如果都处于基态,那化学性质就和氦原子一样稳定。宇宙中基本上所有原子的状态都稳如泰山,就不会轻易形成化学键,那么有机物就不会存在,生命自然也就不会存在。

所以从这种角度来看,地球上存在生命又得多感谢一位。人类不仅要感谢引力、电磁力、暗能量、超新星爆炸抛射的重元素、太阳的能量、地球磁场、木星的守卫、海底温泉形成的luca,还得感谢大自然创造了泡利不相容原理!
你可能还想知道,既然我们不能确定电子在哪里,那么我们怎么画出电子云模型呢?
其实,我们可以用一个概念来帮助我们,叫做轨道密度。轨道密度就是表示在某个空间范围内找到电子的概率有多大。轨道密度越大,表示找到电子的概率越大,轨道密度越小,表示找到电子的概率越小。我们可以用不同的颜色或亮度来表示轨道密度的大小,比如红色表示轨道密度大,蓝色表示轨道密度小。这样,我们就可以画出一个彩色的电子云图,它可以反映出电子在原子核外空间的分布情况。

当然,这种电子云图并不是真实的电子云,它只是一个统计的结果,它不能告诉我们电子在某一时刻确切的位置。电子云图只能告诉我们,在很多次观测中,电子出现在某个位置的概率有多大。如果我们观测得足够多次,我们就会发现电子出现的位置和电子云图的轨道密度是一致的。

你可能还想知道,既然电子云模型是用概率来描述电子的分布,那么它有什么优势呢?为什么我们要用这种模型来代替之前的轨道模型呢?
其实,电子云模型有很多优势,比如:
电子云模型更符合量子力学的原理,它不违反不确定性原理,也不违反泡利不相容原理。电子云模型可以更好地解释原子的光谱现象,它可以预测出原子发射或吸收光线的波长和强度。电子云模型可以更好地解释原子之间的化学键形成,它可以说明为什么有些原子能够共享或转移电子,形成不同类型的化学键。
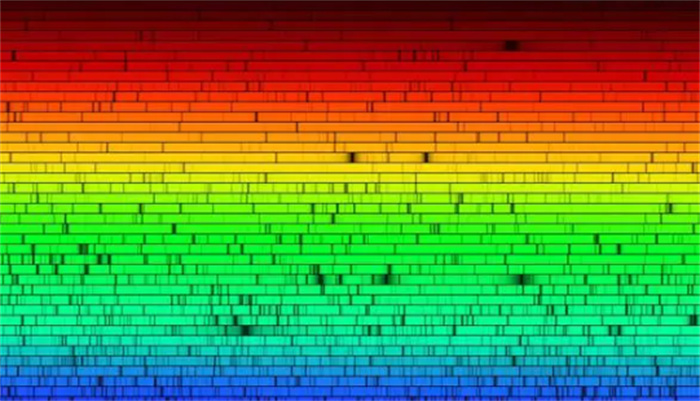
总之,电子云模型是一个更先进、更科学、更准确的模型,它可以让我们更深入地了解原子结构和化学性质。当然,这个模型也不是完美的,它还有很多需要改进和完善的地方。比如,它只能精确地解出氢原子和类氢原子(只有一个核外电子)的波函数,对于多电子原子,它只能用近似方法来求解。比如,它还不能完全解释原子核和电子之间的相互作用,对于重元素(原子序数较大)的原子结构和化学性质,它还有很多困难。
所以,我们人类完全不能满足于现有的知识,还要继续探索和学习,才能发现更多的奥秘和真理。
你可能还有很多关于电子云模型的疑问和想法,
欢迎你在评论区留言和大家分享讨论。
也许你就是下一个量子力学的天才呢!
意外考试悖论 预料不到的考试(破解方法揭秘)
导语:意外考试悖论,也被称之为刽子手悖论,主要是讲老师宣布在下周的某天进行意外的考试,根据这个逻辑,最终排除最后一天考试的可能,因为大家事先知道了会考试,所以不会感觉到意外,以此类推,接下来的每一天都不可能进行考试,而这与预言是相互矛盾的,探秘志带大家了解一下。意外考试悖论主要内容我要新鲜事2023-05-09 01:20:300000法拉第未来FF 91前三位车主公布 贾跃亭“不坑穷人”
日前,焕然一新的FF912.0正式发布并开启预订,随后FF官方陆续公布了新车前三位车主。其中一位是豪华汽车经销商,一位是艺术界颇具影响力的人物,第三位是豪宅领域的顶级地产经纪人,均是行业中的精英。我要新鲜事2023-07-13 08:51:590000要是爆发第三次世界大战 那个国家会最先消失?(战争荼毒)
爆发核战争没有一个国家可以幸免。如果第三次世界大战爆发,哪个国家最有可能从世界地图上消失?对这部分知识展开表面的了解,请不要当真,理性地看待它。不管是哪个国家,第一反应就是想到日本,不要基于情感给出答案,而是抛开主观想法。完全用客观事实来分析。首先,日本地理位置微妙,自然灾害频发。尤其是作为一个岛国,四面环海,陆地每年都受到海平面的影响。被针对的国家我要新鲜事2023-05-15 15:13:350000爱因斯坦的预言,黑洞照片发布(人马座A)
在宇宙深处有数百万颗恒星,当这些恒星消亡时,它们会向中心坍缩,形成黑洞。宇宙有130多亿年的历史,银河系有100多亿年的历史,在过去的100亿年里,许多恒星已经死亡并变成了黑洞。所以,银河系中黑洞的数量相当惊人。我要新鲜事2023-05-14 08:57:540001江西佳时特数控技术有限公司深耕机床领域——“数字大脑”指挥生产制造
“我们这套机床设备是根据客户特殊要求定制的,优异性能得到充分认可。”在位于江西省南昌市小蓝经济开发区的江西佳时特数控技术有限公司(以下简称“佳时特”)的生产车间里,佳时特公司董事长刘华说,公司研发的新产品已销往国内多地各个行业。0000





